Über uns
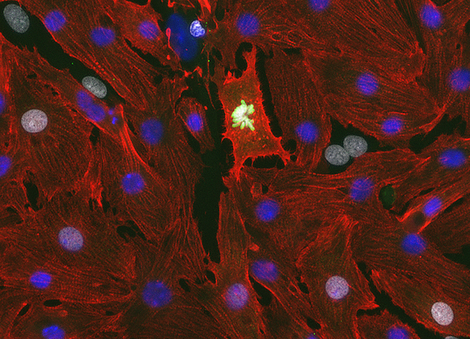
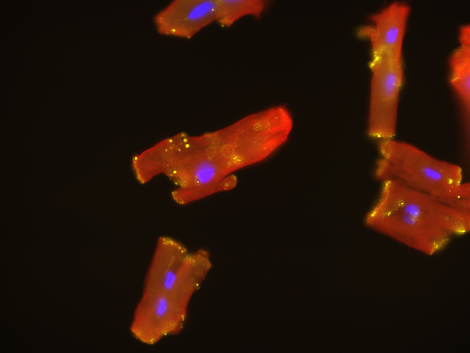
Der Verlust von Kardiomyozyten infolge von Herzerkrankungen und -verletzungen ist eine der Hauptursachen für Morbidität und Mortalität. Wir haben mit Hilfe der retrospektiven 14C-Geburtsdatierung1 gezeigt, dass die Erneuerung der Kardiomyozyten beim Menschen während des gesamten Lebens auf einem niedrigen Niveau bleibt2,3. Diese Erkenntnis hat die Möglichkeit eröffnet, die Kardiomyozytenerneuerung bei Herzkrankheiten zu steigern, indem die zugrunde liegenden zellulären und molekularen Mechanismen der Kardiomyozytenproliferation aufgeklärt werden. Unsere Gruppe konzentriert sich auf das Verständnis der Erneuerung und des Verlusts menschlicher Kardiomyozyten während des biologischen Alterungsprozesses und bei Krankheiten, indem wir aus Stammzellen gewonnene Kardiomyozyten verwenden und komplexe zellbasierte Modelle entwickeln. Unser Ziel ist es, die Auswirkungen der Zelltypzusammensetzung, der Zell-Zell-Interaktion, der Zellzyklusdynamik und der Reifung der Kardiomyozyten auf die Herzregeneration zu untersuchen. Unsere Gruppe verwendet maßgeschneiderte Zellzyklusindikatoren, um die Transkriptionsmuster zu analysieren, die für die Regulierung der Zellteilung erforderlich sind, und nutzt Substanzbibliotheken, um proliferationsfördernde kleine Moleküle zu identifizieren4,5. Das übergeordnete Ziel ist die Identifizierung grundlegender Regenerationsmechanismen, die zur Verbesserung der Funktion des erkrankten menschlichen Herzens eingesetzt werden können.
Referenzen
1. Heinke, P., Rost, F., Rode, J., Trus, P., Simonova, I., Lázár, E., Feddema, J., Welsch, T., Alkass, K., Salehpour, M., et al. (2022). Diploid hepatocytes drive physiological liver renewal in adult humans. Cell Systems. 10.1016/j.cels.2022.05.001.
2. Bergmann, O., Bhardwaj, R.D., Bernard, S., Zdunek, S., Barnabe-Heider, F., Walsh, S., Zupicich, J., Alkass, K., Buchholz, B.A., Druid, H., et al. (2009). Evidence for Cardiomyocyte Renewal in Humans. Science 324, 98–102.
3. Bergmann, O., Zdunek, S., Felker, A., Salehpour, M., Alkass, K., Bernard, S., Sjostrom, S.L., Szewczykowska, M., Jackowska, T., Remedios, C.D., et al. (2015). Dynamics of Cell Generation and Turnover in the Human Heart. Cell, 1566–1575.
4. Baniol, M., Murganti, F., Smialowska, A., Panula, J., Lázár, E., Brockman, V., Giatrellis, S., Derks, W., and Bergmann, O. (2021). Identification and characterization of distinct cell cycle stages in cardiomyocytes using the FUCCI transgenic system. Exp. Cell Res., 112880.
5. Murganti, F., Derks, W., Baniol, M., Simonova, I., Trus, P., Neumann, K., Khattak, S., Guan, K., and Bergmann, O. (2022). FUCCI-Based Live Imaging Platform Reveals Cell Cycle Dynamics and Identifies Pro-proliferative Compounds in Human iPSC-Derived Cardiomyocytes. Frontiers in Cardiovascular Medicine 9. 10.3389/fcvm.2022.840147.
6. Derks, W., and Bergmann, O. (2020). Polyploidy in Cardiomyocytes: Roadblock to Heart Regeneration? Circ. Res. 126, 552–565.
Kontaktinformationen
- Telefon: +49 551 395796
- E-Mail-Adresse: olaf.bergmann(at)med.uni-goettingen.de
- Ort / Raum: 4.D2. 601-602
ORCID: 0000-0003-1065-4107
CV
Ausgewählte Publikationen
- Lundquist A, Lázár E, Han NS, Emanuelsson EB, Reitzner SM, Chapman MA, Shirokova V, Alkass K, Druid H, Petri S, Sundberg CJ, Bergmann O. FiNuTyper: design and validation of an automated deep learning-based platform for simultaneous fiber and nucleus type analysis in human skeletal muscle. Acta Physiol (Oxf). 2023 Apr 25:e13982. doi: 10.1111/apha.13982. PMID: 37097015.
- Heinke P, Rost F, Rode J, Trus P, Simonova I, Lázár E, Feddema J, Welsch T, Alkass K, Salehpour M, Zimmermann A, Seehofer D, Possnert G, Damm G, Druid H, Brusch L, Bergmann O. Diploid hepatocytes drive physiological liver renewal in adult humans. Cell Syst. 2022 Jun 15;13(6):499-507.e12. doi: 10.1016/j.cels.2022.05.001. Epub 2022 May 31.
- Murganti F, Derks W, Baniol M, Simonova I, Trus P, Neumann K, Khattak S, Guan K, Bergmann O. FUCCI-Based Live Imaging Platform Reveals Cell Cycle Dynamics and Identifies Pro-proliferative Compounds in Human iPSC-Derived Cardiomyocytes. Front Cardiovasc Med. 2022 Apr 25;9:840147. doi: 10.3389/fcvm.2022.840147.
- Alkass K, Panula J, Westman M, Wu TD, Guerquin-Kern JL, Bergmann O. No Evidence for Cardiomyocyte Number Expansion in Preadolescent Mice. Cell. 2015 Nov 5;163(4):1026-36.
- Bergmann, O. *§, S. Zdunek§, A. Felker, M. Salehpour, K. Alkass, S. Bernard, S. L. Sjostrom, M. Szewczykowska, T. Jackowska, C. G. Dos Remedios, T. Malm, M. Andrä, R. Jashari, J. R. Nyengaard, G. Possnert, S. Jovinge, H. Druid and J. Frisén. Dynamics of cell generation and turnover in the human heart. Cell. 2015 Jun 18;161(7):1566-75.


