Über uns
Das Hauptziel unserer Forschungstätigkeit ist die Erforschung der grundlegenden kardiovaskulären Biologie. Unser Team interessiert sich insbesondere für die Funktion der transkriptionellen und posttranskriptionellen Maschinerie des sich entwickelnden, erkrankten und normalen Herzmuskels. Ein besonderer Schwerpunkt liegt auf evolutionär konservierten endogenen Mechanismen, einschließlich der nukleären Wnt-Signalkomplexe und ihrer Rolle beim Gewebeumbau. Unsere Modelle umfassen präklinische Tier- und humanisierte Modelle. Unser Ziel ist es, unser gewonnenes Wissen und unsere Erfahrung zu nutzen, um krankheitsspezifische und personalisierte therapeutische Optionen zu definieren und schließlich CRISPR-basiertes endogenes Transkriptions-Engineering zur therapeutischen Programmierung eines homöostatischen Herzens zu etablieren. Dies ist durch die Einbettung des Prozesses in ein führendes, hochmodernes kardiovaskuläres Forschungsumfeld mit modernster Technologie möglich.

Kontaktinformationen
- Telefon: +49 551 3968186
- E-Mail-Adresse: laura.zelarayan(at)med.uni-goettingen.de
Adresse
Robert-Koch-Straße 40
37075 Göttingen
ORCID: 0000-0002-9001-0346
Der transkriptionelle Wnt-Komplex des Herzens
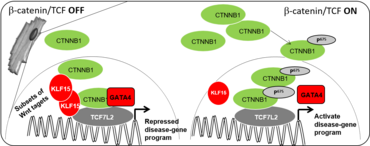
Die transgene Aktivierung der Wnt/β-Catenin-Signalübertragung führt zu einer kardialen Dysfunktion. Dementsprechend blieb die Funktion nach ischämischer Belastung und Drucküberlastung erhalten, wenn der Wnt/b-Catenin-Signalweg im erwachsenen Mausherz gehemmt wurde. Unser Team hat gezeigt, dass eine abnorm hohe Wnt/β-Catenin/TCF-vermittelte Aktivität in adulten Kardiomyozyten eine transkriptionelle Umprogrammierung (Dedifferenzierung), die Aktivierung von Entwicklungsprozessen, die den Zellzyklus einschließen, eine Mehrfachkernbildung und ein Sekretom auslöst, die ein entwicklungsbedingtes Programm zum Umbau von Gefäßzellen aktivieren, das schließlich zu Herzversagen führt. Unser Ziel ist es, die Wnt-abhängigen Mechanismen zu entschlüsseln, die die Bildung von kardiovaskulärem Gewebe, die Homöostase des Herzens und den Umbau in einer zell- und kontextspezifischen Weise steuern. Darüber hinaus ist der Transkriptionsfaktor 7-like 2 (TCF7L2) eine wichtige Determinante der nachgeschalteten Wnt-Zielgenexpression und wird durch gewebespezifische Inhibitoren streng kontrolliert. Somit ist der Wnt-Kernweg ein vielversprechender pharmakologischer Zielkandidat für die Beeinflussung der Auslösung eines maladaptiven Herzumbaus und der Progression der Herzinsuffizienz. Allerdings ist es schwierig, den Wnt-Signalweg pharmakologisch zu beeinflussen, da er in vielen Geweben eine zentrale Rolle spielt. Wir haben kürzlich KLF15 als kardiomyozytenspezifischen Regulator der Wnt/β-Catenin-Signalübertragung identifiziert und seine Interaktion als dreiteiligen Komplex definiert, der mit Chromatin und der Regulierung des Chromatinzustands verbunden ist. Wir klären die Struktur und Stabilität des Wnt/β-Catenin/KLF5-Komplexes als Grundlage für die Entwicklung von Medikamenten auf.
Synthetische Transkription zur Steuerung des Zellverhaltens
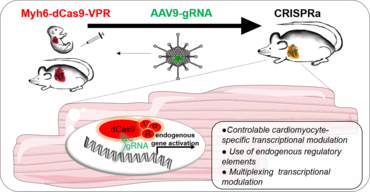
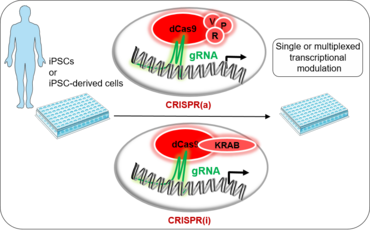
Um therapeutische Konzepte zur Wiederherstellung des Herzens nach einer Schädigung zu finden, müssen mehrere Ziele manipuliert werden, die die genregulatorischen Netzwerke (GRN) beeinflussen. Um eine solche Therapie zu entwickeln, müssen die grundlegende Biologie der Kardiomyozyten und ihre zellulären und molekularen Netzwerke in ihrer natürlichen Umgebung in vivo untersucht werden. Noch wichtiger ist, dass dies in einer krankheitsspezifischen Weise aufgeklärt werden muss. Die CRISPR/Cas9-Technologie wurde so angepasst, dass sie ihre katalytische Aktivität vollständig verliert und mit Transkriptionsaktivatoren (CRISPRa) oder Repressoren (CRISPRi) fusioniert wird, um die Genexpression zu modulieren. CRISPRa/i hat die Beschränkungen früherer Methoden der Transkriptionsmodulation überwunden. Vor allem kann es so gestaltet werden, dass es ein noch nie dagewesenes Maß an Kontrolle ermöglicht und gleichzeitig eine Multiplexing-Möglichkeit bietet. Das Multiplexing ermöglicht die Modulation mehrerer Gene innerhalb desselben Signalwegs und potenziert so den Synergieeffekt der streng regulierten endogenen GRNs. Noch wichtiger ist, dass das katalytisch inaktive Cas9 nur begrenzte unerwünschte Auswirkungen hat und das Genom unberührt lässt, was für therapeutische Anwendungen sehr erwünscht ist. All diese Elemente werden in unseren Studien zur Entschlüsselung komplexer endogener Regulationsmechanismen in der Biologie von Kardiomyozytenerkrankungen genutzt.
Unsere Methodik basiert auf der biochemischen, epigenetischen, transkriptionellen und funktionellen Untersuchung neu identifizierter Faktoren unter Verwendung klassischer Maus-Knockout-Strategien in Kombination mit der Kultur von Mäuse-Embryonen durch Elektroporation (EP), Gewebeexplantaten und humanen induzierten pluripotenten Stammzellen (IPSCs) und schließlich Gewebezüchtung (in Zusammenarbeit mit dem Team von Prof. Zimmermann). Die Verwendung von humanen Proben (Herzbiopsien und Serum) wird mit einbezogen, um die für den Menschen relevanten Mechanismen zu validieren. Unsere Gruppe hat den CRISPR-Werkzeugkasten in der Maus und in IPSCs erweitert. Die CRISPR/Cas9-basierte Technologie wird sowohl für das Gene Editing (knockout und knockin) als auch für die Transkriptionsmodulation in vitro in vivo eingesetzt.
Auszeichnungen
- 2020 - DZHK January 2020 Paper of the Month [here]
- 2019 - Teaching Award at the University Medical Center Goettingen (UMG)
- 2019 - Basic Science Poster Prize, German Cardiac Society (DGK) Basic Science Meeting awarded to Eric Schoger
Ausgewählte Publikationen
*bezeichnet den gleichen Beitrag
- Orr Shomroni, Maren Sitte, Julia Schmidt, Sabnam Parbin, Fabian Ludewig, Gökhan Yigit, Laura Cecilia Zelarayan, Katrin Streckfuss-Bömeke, Bernd Wollnik and Gabriela Salinas. A novel single‑cell RNA‑sequencing approach and its applicability connecting genotype to phenotype in ageing disease. Scientific Reports 12, 4091 (2022). PubMed PMID: 35260714.
- Yanpu Chen, Felipe F. Lüttmann, Eric Schoger, Hans R. Schöler, Laura C. Zelarayán, Kee-Pyo Kim, Jody J. Haigh, Johnny Kim,* and Thomas Braun. Reversible reprogramming of cardiomyocytes to a fetal state drives adult heart regeneration in mice. Science 373(6562):1537-1540 (2021) PubMed PMID: 34554778.
- Franziska S. Rathjens, Lavanya M. Iyer, Anke Renger, Fahima Syeda, Claudia Noack, Andreas Jungmann, Matthias Dewenter, Karl Toischer, Ali El-Armouche, Oliver J. Müller, Larissa Fabritz, Wolfram-Hubertus Zimmermann, Laura C. Zelarayán* and Maria-Patapia Zafeiriou*. Preclinical evidence for the therapeutic value of TBX5 normalization in arrhythmia control. Cardiovascular Research cvaa239 (2020). (*corresponding authors) PubMed PMID: 32777030.
- Schoger E, Carroll KJ, Iyer LM, McAnally JR, Tan W, Liu N, Noack C, Shomroni O, Salinas G, Groß J, Herzog N, Doroudgar S, Bassel-Duby R, Zimmermann WH, Zelarayán LC. CRISPR-mediated activation of endogenous gene expression in the postnatal heart. Circ Res 3;126(1):6-24 (2020) PubMed PMID: 31730408.
- Claudia Noack*, Lavanya M. Iyer*, Norman Y. Liaw, Eric Schoger, Sara Khadjeh, Eva Wagner, Monique Woelfer, Maria-Patapia Zafiriou, Hendrik Milting, Samuel Sossalla, Katrin Streckfuss-Boemeke, Gerd Hasenfuss, Wolfram-Hubertus Zimmermann, and Laura C. Zelarayán. KLF15-Wnt-dependent cardiac reprograming reveals a novel vascular player, SHISA3 in the mammalian heart. Journal of the American College of Cardiology 74(14):1804-1819 (*contributed equally) (2019) PubMed PMID: 31582141.
- Lavanya M. Iyer, Sankari Nagarajan, Monique Woelfer, Eric Schoger, Sara Khadjeh, Maria Patapia Zafiriou, Vijayalakshmi Kari, Jonas Herting, Sze Ting Pang, Tobias Weber, Franziska S. Rathjens, Thomas H. Fischer, Karl Toischer, Gerd Hasenfuss, Claudia Noack, Steven A. Johnsen and Laura C. Zelarayán. A context-specific cardiac Beta-catenin and GATA4 interaction influences TCF7L2 occupancy and remodels chromatin driving disease progression in the adult heart. Nucleic Acids Research 46(6):2850-2867 (2018) PubMed PMID: 29394407.
- Noack C, Zafiriou MP, Schaeffer HJ, Renger A, Pavlova E, Dietz R, Zimmermann WH, Bergmann MW, Zelarayán LC. Krueppel-like factor 15 regulates Wnt/beta-catenin transcription and controls cardiac progenitor cell fate in the postnatal heart. EMBO Mol Med 4: 992-1007 (2012) PubMed PMID: 22767436.
Mitglieder AG Zelarayan
Alumni
- Dr. Federico Bleckwedel
- Dr. Elena Chebbok
- Dr. Lavanya Iyer
- Gabriela Maria Lobo Vallejo
- Dr. Claudia Noack
- Dr. med. Laura Priesmeier
- Dr. Franziska Rathjens
- Dr. Anke Renger
- Dr. Cheila Rocha
- Dr. Eric Schoger
- Dr. Monique Wölfer