Einrichtungen
Unsere Methoden und Technologien
Entwicklung von Gewebeorganoiden
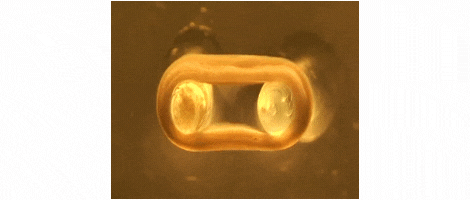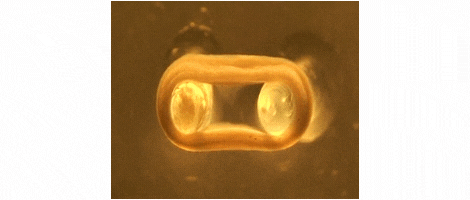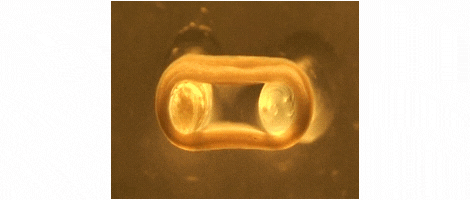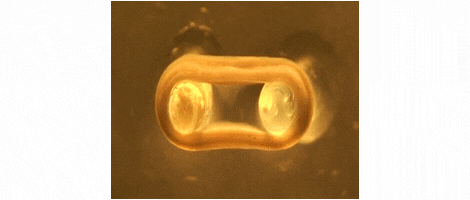
Wir entwickeln Technologien für das Tissue-Engineering mit Schwerpunkt auf der Herstellung von Herz- und Skelettmuskeln für Medikamententests, Krankheitssimulation und Organreparatur. Wir konzentrieren uns auf Ratten-, Maus- und Menschenmodelle.
![[Translate to Deutsch:] Multi Electrode Array ‚Maestro Pro‘ (Axion Biosystems)](/fileadmin/_processed_/a/b/csm_Zafeiriou_Schmoll_Multi_Electrode_Array_740c2bbd33.jpg)
Kultur und Differenzierung von Stammzellen
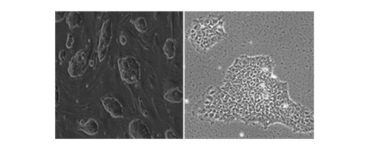
Wir kultivieren und differenzieren Herzzellen von Mäusen, Rhesusaffen und menschlichen embryonalen Stammzellen (ESC), induzierten pluripotenten Stammzellen (iPSC) und parthenogenetischen Stammzelllinien (PSC). Menschliche iPSC werden in der Stammzelleneinheit (SCU) erzeugt.
Stammzelleinheit
Die Stammzelleinheit ist eine nicht-kommerzielle Serviceplattform an der Universitätsmedizin Göttingen (UMG). Sie wird vom Deutschen Zentrum für Herz- Kreislauf-Forschung (DZHK) und der UMG finanziert.
Ihr Ziel ist es, patientenspezifische induzierte pluripotente Stammzellen (iPS-Zellen) für die Forschungsgemeinschaft des Göttingen Research Council (GRC) und seiner Partner bereitzustellen. Alle iPS-Zellgenerationen folgen etablierten und validierten SOPs.
Kontakt

Kontaktinformationen
- Telefon: +49 551 3964280
- E-Mail-Adresse: lukas.cyganek(at)gwdg.de
Muskelpharmakologie und -biophysik
Wir verwenden isometrische Kraftmessungen und dynamische mechanische Analysen, um die Gewebeeigenschaften von künstlichem und natürlichem Muskelgewebe zu bestimmen.
![[Translate to Deutsch:] Organ Bath](/fileadmin/_processed_/0/3/csm_Construction_Setup_Organ_Bath_6d1bb8f0df.jpg)
![[Translate to Deutsch:] nanoString nCounter](/fileadmin/_processed_/3/8/csm_nanostring_2_86e4772034.jpg)
![[Translate to Deutsch:] Langendorff-System](/fileadmin/_processed_/9/e/csm_D%C3%B6ring_Voigt_Langendorff-System_c0f5eefea5.jpg)
![[Translate to Deutsch:] Tissue Organ Bath System (Detail)](/fileadmin/_processed_/c/3/csm_Tissue_Organ_Bath_System_Detail_a51b565920.jpg)
3-Dimensionales Prototyping
Wir verwenden CAD-Design und 3D-Druck zur Entwicklung von Prototypen, Gussformen und Trägermaterialien für Tissue Engineering, Zellkultur, Elektrophysiologie und andere Anwendungen.


Durchflusszytometrie

Unser Labor verfügt über ein Becton Dickinson LSRII-Zytometer, das mit 5 Lasern (355 nm, 405 nm, 488 nm, 561 nm und 640 nm Anregung) und bis zu 18 Detektoren für Multicolor-Experimente ausgestattet ist.

Makro- and Mikroskopie
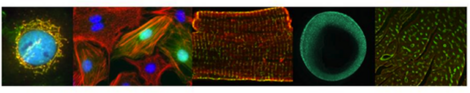
![[Translate to Deutsch:] Sharp Microelectrode Setup](/fileadmin/_processed_/e/3/csm_RubioVoigt_Sharp_Micro_Electrodes_Setup_0d738f2dbe.jpg)
![[Translate to Deutsch:] Confocal Microscope](/fileadmin/_processed_/2/9/csm_Zelarayan_vor_Confocal_Microscope_eb7b65ffde.jpg)
Neben makroskopischen Methoden verwenden wir Standard-Lichtmikroskopie, konfokale Mikroskopie und 2-Photonen-Mikroskopie in fixierten und lebenden Proben unter kontrollierten Umweltbedingungen; Ausrüstung: IX-81 mit Lebendzellkammer (Olympus), SteREO Lumar.V12 (Zeiss), LSM 710 NLO (Zeiss), Dual-Ultima L System (SciMedia), TCS LSI (Leica), Functional Optical Imaging (Ionoptix, Andor), Spectral Karyotyping (SKY).
Hochdurchsatz Screens



Hochdurchsatzaufnahmen der zellulären Elektrophysiologie
Unsere neue Technologieplattform bietet Zugang zu einem Patch-Clamp-Roboter „SyncroPatch 384“ von Nanion Technologies. Dieser ermöglicht Hochdurchsatz-Aufnahmen der zellulären Elektrophysiologie von isolierten Kardiomyozyten und Neuronen.
Wir verwenden mehrere Screening-Plattformen mit hohem Durchsatz zur Analyse von Absorption, Fluoreszenzintensität, Fluoreszenzpolarisation, zeitaufgelöster Fluoreszenz und Lumineszenz; Geräte: FlexStation 3 (Molecular Devices), GloMax® 96 Mikroplatten-Luminometer (Promega), Cellavista (SynenTec GmbH).



Histologie
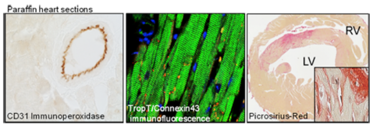
Wir führen histologische Standardanalysen, Immunhistochemie und Immunfluoreszenzmarkierungen in Paraffin- (1-4 µm, Leica RM 2255), Kryo- (6-20 µm, Leica CM 3050S) und Vibratomschnitten (20-150 µm, Leica VT 1000 S) durch.
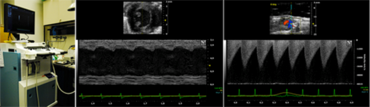
Bildgebung und Interventionen bei Kleintieren
Wir führen eine umfassende kardiovaskuläre Phänotypisierung in Nagetiermodellen mit Myokardinfarkt und Herzinsuffizienz mittels Ultraschall-Biomikroskopie (Vevo 2100 Imaging Systems, VisualSonics) und minimal-invasiver Telemetrie (DSI) durch.